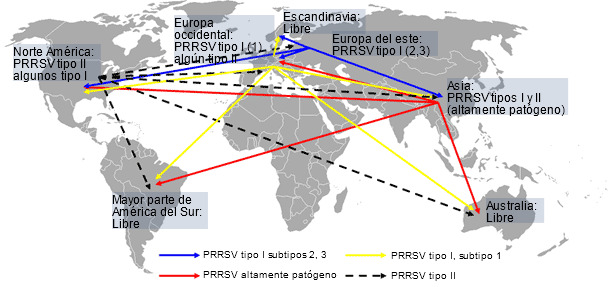
Un estudio reciente llevado a cabo por la Universidad de Iowa reveló que el síndrome respiratorio y reproductivo porcino (PRRS) sigue causando grandes pérdidas económicas a los porcicultores de los EEUU. Los investigadores han estimado que el coste del PRRS asciende a $664 millones anuales o $1,8 millones al día (Holtkamp D, et al. 2011). Otros informes sugieren que el impacto de la enfermedad en Canadá, México, Asia y Europa del este parece ser similar. Desde el inicio de la enfermedad, hace más de 20 años, los tipos I y II de virus de PRRS se han diseminado geográficamente, ganando diversidad genética y, probablemente, aumentado su virulencia (Murtaugh MP, et al. 2010; Li B, et al. 2006). En la Europa occidental, sin embargo, el impacto económico del PRRS todavía está en debate con informes muy dispares, que van desde brotes muy severos a casos subclínicos. La menor severidad de la enfermedad en Europa puede ser debida a su relativa alta prevalencia, al predominio de ciclos cerrados y a la predominancia de aislados tipo I que, a pesar de presentar una amplia diversidad genética (Stadejek T, et al. 2008), inducen signos respiratorios menos severos que los aislados tipo II (Martinez-Lobo FJ, et al. 2011). Independientemente de esta interesante discusión, el riesgo de la introducción de nuevos aislados (cepas) del PRRSV, tipo I o II, en áreas de alta densidad porcina con predominancia de ciclos cerrados en la Europa occidental sigue estando presente. Además, el riesgo de transmisión intercontinental de los aislados altamente patógenos del virus de PRRS detectados en Asia también es real. Al mismo tiempo, en otras partes del mundo como Australia, la mayor parte de América del sur y Escandinavia, la introducción de cualquier virus de PRRS podría ser catastrófica para las industrias locales (figura 1). Esta situación global indica que el virus de PRRS por sí mismo, así como el riesgo y potenciales consecuencias de su transmisión entre regiones, no debe ser subestimado.
Figura 1. Distribución global del virus de PRRS e hipotética transmisión intercontinental

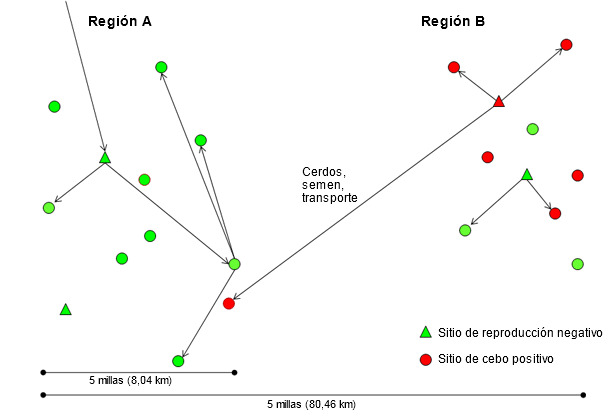
Sin una metodología validada para agrupar los aislados víricos de PRRS y para el propósito de este artículo, se considerará como aislado “nuevo” el que sea, al menos, heterólogo (diferente) en un 3% de su secuencia ORF 5 respecto a cualquiera previamente detectado en el sistema (empresa) o región durante los últimos 3 años. Un aislado “residente” será justo lo contrario. En varios casos este umbral arbitrario puede no tener ningún significado y se utilizará sólo como valor de referencia. La rápida diseminación del virus PRRS a largas distancias durante los años 90 y el relativo confinamiento geográfico de los aislados residentes en los últimos años, cuando se han utilizado protocolos de monitorización más sensibles, sugieren que los nuevos aislados del virus necesitan cerdos vivos, semen o vehículos contaminados para transmitirse entre regiones (figura 2). Como hipótesis, los nuevos aislados de virus PRRS se originan a partir de continuos cambios del virus en las regiones con transmisión constante dentro, y entre, explotaciones (región B en la figura 2). En países donde se pretende mantener las granjas de multiplicación y los centros de inseminación PRRSV negativos, donde se han realizado progresos importantes en los protocolos de cuarentena y de distribución de semen, la causa más común de transmisión a larga distancia es el movimiento de cerdos destetados y de cebo positivos a PRRSV y el uso de vehículos de transporte contaminados (región A en la figura 2). Por desgracia, la distribución de reposición y de semen positivos a PRRSV continúa produciéndose en varios países. Considerar que una región, sistema o granja, por el hecho de ser positivo a un aislado de PRRSV, pueda aceptar semen o reposición positivos a PRRSV es muy peligroso ya que siempre podría introducirse un aislado más virulento.
Figura 2. Introducción de un nuevo aislado del virus del PRRS de la región B a la A
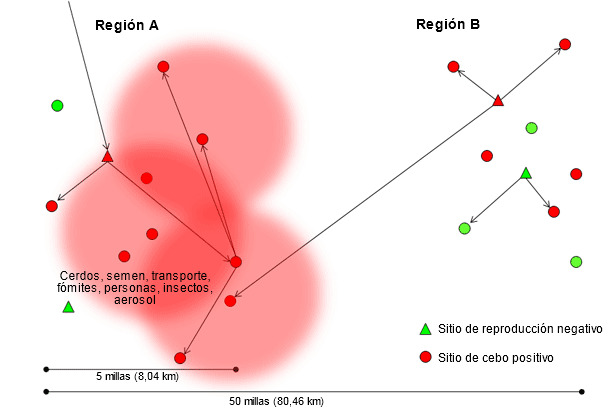
La investigación que los Drs. Scott Dee y Satoshi Otake han llevado a cabo demuestra que el virus de PRRS puede transmitirse entre explotaciones a través de los vehículos de transporte (Dee SA, et al. 2004), fómites (Otake S, et al. 2002), personas (Otake S, et al. 2002), insectos (Otake S, et al. 2004), purines y aerosol (Dee SA, et al. 2005). La transmisión mediante estas vías indirectas es probable que ocurra en distancias relativamente cortas, desde la primera explotación infectada con el nuevo aislado (figura 2), en áreas de alta densidad porcina y que probablemente se vea agravada por unas medidas de bioseguridad deficientes. Normalmente cuando la primera explotación se infecta, varias explotaciones recibirán cerdos con infección aguda convirtiéndose en amplificadores de este aislado concreta de PRRSV (región A en la figura 3). En esta situación no puede hacerse gran cosa para detener o reducir la epidemia. Curiosamente, entre los numerosos aislados distintos que se identifican en zonas de alta densidad porcina cada año, sólo unas pocas son capaces de transmitirse entre explotaciones y todavía son menos las capaces de diseminarse ampliamente y dominar toda una región o sistema. El factor que determina qué aislados del virus de PRRS se diseminan con éxito y persisten en áreas geográficas, o en flujos de cerdos, tiene que investigarse con más profundidad; sin embargo, puede hipotetizarse que estarían involucradas la capacidad del aislado para replicarse con eficacia en los cerdos, su capacidad para transmitirse mediante múltiples rutas incluyendo los aerosoles y la existencia de poblaciones de cerdos capaces de mantener la infección y diseminar de este modo cantidades significativas de virus durante un periodo de tiempo.
Figura 3. Diseminación de un nuevo aislado de virus de PRRS a través de la región A
Estudios controlados indican que cuando los cerdos susceptibles son expuestos a virus vivos salvajes de PRRS pueden excretarlo durante 70 a 100 días (Cano JP, et al. 2007; Linhares D, et al. 2012). Las poblaciones grandes de cerdos negativos sirven como amplificadores del virus en la región recién infectada y representan un riesgo significativo para granjas vecinas durante mucho tiempo. Los mismos estudios revelan que el uso de vacunas vivas modificadas en estas poblaciones recientemente infectadas reduce la duración de la excreción en unos 30 días. También se espera que las poblaciones que han desarrollado inmunidad contra virus vivos de PRRS excreten un virus heterólogo (de nueva introducción) en menores cantidades y durante menos tiempo que la primera vez que fueron expuestos o que poblaciones completamente susceptibles. Pese a que los cerdos negativos en la fase de crecimiento amplifican los nuevos aislados, el reservorio de los aislados de PRRSV en una región está en los cebaderos de flujo continuo endémicamente infectados o los ciclos cerrados. Si los cerdos se engordaran en sistemas todo dentro/todo fuera muy probablemente el nuevo aislado se eliminaría de un sitio en unos pocos meses. Los resultados observados en planes piloto de control regional sugieren que el principio de homogenización de la inmunidad por exposición que se ha aplicado con éxito a nivel de explotación para controlar el PRRSV puede representar una alternativa viable al control regional.
En resumen, el reto que el PRRS impone a regiones o empresas podría superarse con la comprensión de la epidemiología del virus y la combinación de estrategias encaminadas a:
- Prevenir nuevas introducciones mediante la aplicación sistemática de un programa de bioseguridad completo.
- Reducir la fuente de nuevos aislados tratando de eliminar el virus de las poblaciones y flujos continuos endémicamente infectados.
- Contener la diseminación de nuevos aislados maximizando la inmunidad de la explotación, la bioseguridad y empleando un sistema de vigilancia integrado para hacer un seguimiento del virus.
- Minimizar el impacto económico de la enfermedad intentando controlar la exposición y la inmunidad a través de estrategias como la filtración del aire, la bioseguridad, la vacunación y la modificación del flujo de cerdos.



